Adalah.Co.Id – Isotop adalah bentuk dari unsur yang nukleusnya memiliki nomor atom yang sama, tetapi jumlah proton dalam nukleus dengan massa atom yang berbeda, karena mereka memiliki jumlah neutron yang berbeda.
Kata isotop, berarti di tempat yang sama, berasal dari fakta bahwa semua isotop unsur berada di tempat yang sama dalam tabel periodik.
Secara bersama, isotop-isotop dari unsur-unsur membentuk suatu set nuklida. Nuklida adalah jenis inti atom tertentu atau lebih umum merupakan aglomerasi proton dan neutron. Bahkan lebih benar untuk mengatakan bahwa unsur seperti fluor terdiri dari nuklida stabil dan bukan bahwa ia memiliki isotop stabil.
Dalam nomenklatur ilmiah, isotop (nukleid) didasarkan pada nama elemen tertentu dari stroke dan jumlah nukleon (proton dan neutron) dalam inti atom (Helium-3, karbon-12, karbon-14, ferro). -57, uranium-238). Jumlah nukleon diberikan dalam bentuk simbolis sebagai awalan naik dari simbol kimia (3He, 12C, 14C, 57Fe, 238U, dll).
Semua atom dari unsur yang sama memiliki jumlah proton yang sama, tetapi beberapa dapat memiliki jumlah neutron yang berbeda. Sebagai contoh, semua atom karbon memiliki enam proton dan sebagian besar juga memiliki enam neutron. Namun, beberapa atom karbon memiliki tujuh atau delapan neutron, bukan enam.
Atom-atom dari unsur yang sama yang berbeda dalam jumlah neutron disebut isotop. Banyak isotop muncul secara alami. Biasanya satu atau dua isotop unsur adalah yang paling stabil dan umum. Isotop elemen yang berbeda umumnya memiliki sifat fisik dan kimia yang sama. Ini karena mereka memiliki jumlah proton dan elektron yang sama.
Penamaan Isotop
Untuk sebagian besar unsur selain hidrogen, isotop dinamai sesuai dengan jumlah massanya. Sebagai contoh, atom karbon dengan 6 neutron memiliki jumlah massa 12 (6 proton + 6 neutron = 12), itulah sebabnya mereka disebut karbon-12. Atom karbon dengan 7 neutron memiliki massa atom 13 (6 proton + 7 neutron = 13). Atom-atom ini adalah isotop yang disebut karbon-13.
Q: Beberapa atom karbon memiliki 8 neutron. Apa nama isotop karbon ini?
A: atom karbon dengan 8 neutron memiliki massa atom 14 (6 proton + 8 neutron = 14), sehingga isotop karbon ini diberi nama karbon-14.
Stabilitas Isotop
Atom membutuhkan rasio neutron dan proton tertentu untuk memiliki inti yang stabil. Terlalu banyak atau terlalu sedikit neutron dalam hal jumlah proton menyebabkan ketidakstabilan atau radioaktivitas, sehingga cepat atau lambat nukleus meluruh menjadi bentuk yang lebih stabil. Proses ini disebut peluruhan radioaktif.
Banyak isotop memiliki inti radioaktif dan isotop ini disebut radioisotop. Ketika mereka membusuk, mereka melepaskan partikel yang bisa berbahaya. Karena alasan ini, isotop radioaktif berbahaya dan memerlukan pakaian pelindung khusus untuk melindunginya. Isotop karbon yang dikenal sebagai karbon-14 adalah contoh radioisotop. Sebaliknya, isotop karbon yang disebut karbon-12 dan karbon-13 stabil.
Contoh Isotop Hidrogen
Hidrogen adalah contoh unsur dengan isotop. Pada gambar berikut tiga isotop hidrogen dimodelkan. Sebagian besar atom hidrogen hanya memiliki satu proton dan satu elektron dan tidak ada neutron. Atom-atom ini hanya disebut hidrogen. Beberapa atom hidrogen juga memiliki neutron. Atom-atom ini adalah isotop yang disebut deuterium. Atom hidrogen lainnya memiliki dua neutron. Atom-atom ini adalah isotop yang disebut tritium.
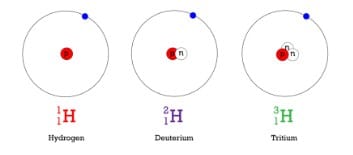
Q: Jumlah massa atom adalah jumlah proton dan neutron. Berapa jumlah massa masing-masing isotop hidrogen yang ditunjukkan pada Gambar di atas?
A: nomor massa: hidrogen = 1, deuterium = 2, dan tritium = 3.
Kesimpulan
Atom dari unsur yang sama yang berbeda dalam jumlah neutron mereka disebut isotop. Berbagai isotop unsur umumnya memiliki sifat fisik dan kimia yang sama karena mereka memiliki jumlah proton dan elektron yang sama.
Sebagian besar atom hidrogen tidak memiliki neutron dan hanya disebut hidrogen. Atom hidrogen dengan neutron adalah isotop yang dikenal sebagai deuterium dan isotop ini dengan dua neutron disebut tritium.
Untuk sebagian besar unsur selain hidrogen, isotop dinamai sesuai dengan jumlah massanya, yang sesuai dengan jumlah proton neutron terbanyak. Sebagai contoh, karbon dengan nomor massa 14 disebut sebagai karbon-14.
Atom membutuhkan hubungan tertentu antara neutron dan proton sehingga memiliki inti yang stabil. Jika mereka memiliki terlalu banyak atau terlalu sedikit neutron dibandingkan dengan proton, mereka adalah radioaktif dan membusuk menjadi bentuk yang lebih stabil. Isotop dengan inti radioaktif disebut radioisotop.
Sekian artikel tentang isotop ini semoga bisa memberi manfaat bagi kita semua, Terimakasih.
Baca Juga Artikel Lainnya >>>